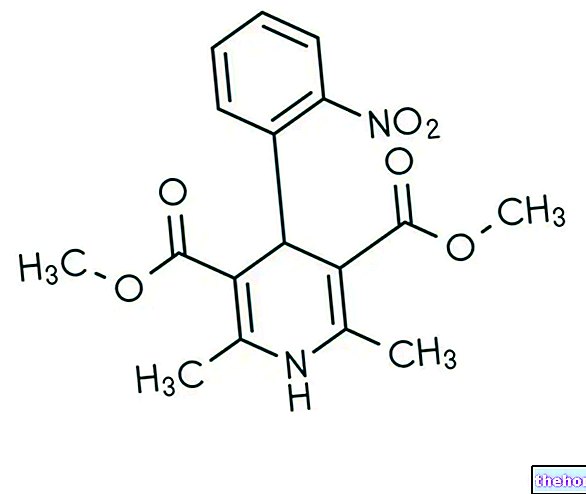
Ingrediente active: Liraglutidă
Victoza 6 mg / ml soluție injectabilă în stilou injector (pen) preumplut
De ce se utilizează Victoza? Pentru ce este?
Victoza conține substanța activă liraglutidă, care ajută organismul să scadă nivelul zahărului din sânge numai atunci când este prea mare și, de asemenea, încetinește trecerea alimentelor în stomac.
Victoza este utilizat împreună cu alte medicamente pentru diabet, atunci când acestea nu sunt suficiente pentru a vă controla nivelul zahărului din sânge. Acestea sunt incluse:
- Medicamente antidiabetice orale (cum ar fi metformină, pioglitazonă, sulfoniluree) și / sau insulină bazală, un tip de insulină cu acțiune îndelungată.
Contraindicații Când nu trebuie utilizat Victoza
Nu utilizați Victoza
- dacă sunteți alergic la liraglutidă sau la oricare dintre celelalte componente ale acestui medicament (enumerate la pct. 6).
Precauții pentru utilizare Ce trebuie să știți înainte de a lua Victoza
Discutați cu medicul dumneavoastră, farmacistul sau asistenta medicală:
- înainte de a utiliza Victoza
- dacă aveți sau ați avut vreodată boală pancreatică.
Acest medicament nu trebuie utilizat dacă aveți diabet de tip 1 (corpul dumneavoastră nu produce insulină) sau cetoacidoză diabetică (o complicație a diabetului zaharat care duce la creșterea glicemiei și dificultăți crescute la respirație). Nu este o insulină și, prin urmare, nu trebuie utilizat ca substitut pentru insulină.
Utilizarea Victoza nu este recomandată dacă aveți boli renale severe sau sunteți dializat.
Există experiență limitată cu privire la utilizarea acestui medicament la pacienții cu probleme hepatice. Utilizarea medicamentului nu este recomandată dacă aveți boli de ficat.
Există puține sau deloc experiențe privind utilizarea acestui medicament la pacienții cu insuficiență cardiacă. Nu este recomandat dacă aveți insuficiență cardiacă severă.
Utilizarea acestui medicament nu este recomandată dacă aveți boli gastro-intestinale severe, manifestate prin golirea gastrică încetinită (numită gastropareză) sau boală inflamatorie a intestinului.
Dacă aveți simptome de pancreatită acută, cum ar fi dureri severe și persistente de stomac, trebuie să vă adresați imediat medicului dumneavoastră (vezi pct. 4).
Dacă aveți o boală tiroidiană, inclusiv noduli și o glandă tiroidă mărită, vă rugăm să vă adresați medicului dumneavoastră.
Când începeți tratamentul cu Victoza, este posibil să aveți pierderi / deshidratare de lichide în unele cazuri, cum ar fi vărsături, greață și diaree. Este important să evitați deshidratarea prin consumul de lichide. Contactați medicul dacă aveți nelămuriri sau întrebări.
Copii și adolescenți
Victoza nu este recomandat la copii și adolescenți cu vârsta sub 18 ani, deoarece eficacitatea și siguranța nu au fost stabilite în această grupă de vârstă.
Interacțiuni Ce medicamente sau alimente pot schimba efectul Victoza
Spuneți medicului dumneavoastră, farmacistului sau asistentei medicale dacă luați, ați luat recent sau s-ar putea să luați orice alte medicamente.
Spuneți în special medicului dumneavoastră, farmacistului sau asistentei medicale dacă utilizați medicamente care conțin oricare dintre următoarele ingrediente active:
- Sulfoniluree (de exemplu glimepiridă sau glibenclamidă). Este posibil să aveți hipoglicemie (glicemie scăzută) dacă utilizați Victoza împreună cu o sulfoniluree, deoarece sulfonilureea crește riscul de hipoglicemie. Când începeți să utilizați aceste medicamente împreună, medicul dumneavoastră vă poate cere să reduceți doza de sulfoniluree. A se vedea secțiunea 4 pentru semnele de avertizare ale scăderii zahărului din sânge. Dacă luați și sulfoniluree (cum ar fi glimepiridă sau glibenclamidă), medicul dumneavoastră ar trebui să vă verifice nivelul zahărului din sânge. Acest lucru îl va ajuta pe medicul dumneavoastră să decidă dacă trebuie modificată doza de sulfoniluree de care aveți nevoie.
- Warfarina sau alte medicamente anti-coagulante orale. Sunt necesare analize de sânge frecvente pentru a determina capacitatea sângelui de a se coagula.
Avertismente Este important să știm că:
Sarcina și alăptarea
Spuneți medicului dumneavoastră dacă sunteți sau credeți că sunteți gravidă sau intenționați să rămâneți gravidă. Victoza nu trebuie utilizat în timpul sarcinii, deoarece nu se știe dacă ar putea dăuna copilului înainte de naștere.
Nu se știe dacă Victoza trece în laptele matern, deci nu utilizați acest medicament dacă alăptați.
Conducerea vehiculelor și utilizarea utilajelor
Scăderea zahărului din sânge (hipoglicemie) vă poate reduce capacitatea de concentrare. Evitați să conduceți vehicule sau să folosiți utilaje dacă prezentați semne de hipoglicemie. A se vedea secțiunea 4 pentru semnele de avertizare ale scăderii zahărului din sânge. Consultați-vă medicul pentru mai multe informații despre acest subiect.
Doză, metodă și timp de administrare Cum se utilizează Victoza: Doze
Utilizați întotdeauna medicamentul exact așa cum v-a spus medicul dumneavoastră. Dacă aveți dubii, consultați medicul, farmacistul sau asistenta medicală.
- Doza inițială este de 0,6 mg o dată pe zi, timp de cel puțin o săptămână.
- Medicul dumneavoastră vă va spune când să îl măriți la 1,2 mg o dată pe zi.
- Medicul dumneavoastră vă poate spune să creșteți în continuare doza la 1,8 mg o dată pe zi dacă nivelul zahărului din sânge nu este controlat în mod adecvat cu o doză de 1,2 mg.
Nu vă modificați doza decât dacă medicul dumneavoastră vă recomandă acest lucru.
Victoza se administrează sub formă de injecție sub piele (subcutanat) .Nu se injectează în venă sau mușchi. Cele mai bune locuri de injectare sunt partea din față a coapselor, abdomenul (burta) sau partea superioară a corpului.
Vă puteți injecta în orice moment al zilei, indiferent de mese.După ce ați ales cel mai convenabil moment, este de preferat să vă injectați Victoza aproximativ la aceeași oră.
Înainte de a utiliza stiloul pentru prima dată, medicul sau asistenta vă vor arăta cum să faceți acest lucru. Instrucțiunile detaliate de utilizare sunt furnizate pe spatele acestui prospect.
INSTRUCȚIUNI PENTRU UTILIZAREA PENULUI VICTOZA.
Vă rugăm să citiți cu atenție aceste instrucțiuni înainte de a utiliza pixul.
Stiloul conține 18 mg liraglutidă. Poate selecta doze de 0,6 mg, 1,2 mg și 1,8 mg. Stiloul este conceput pentru a fi utilizat cu ace de unică folosință NovoFine și NovoTwist de până la 8 mm lungime și până la 32 G (0,25 / 0,23 mm) subțiri.
Pregătirea stiloului
Verificați numele și eticheta de culoare de pe stilou pentru a vă asigura că conține liraglutidă. Utilizarea unui medicament incorect vă poate afecta grav. Scoateți capacul din stilou.
Scoateți sigiliul de protecție dintr-un nou ac de unică folosință. Înșurubați ferm acul drept pe stiloul dvs. Trageți capacul exterior al acului și păstrați-l pentru mai târziu. Scoateți capacul interior al acului și aruncați-l.
- Utilizați întotdeauna un ac nou pentru fiecare injecție. Acest lucru reduce riscul de contaminare, infecție, scurgeri de liraglutidă, ace înfundate și doze inexacte.
- Aveți grijă să nu îndoiți sau să deteriorați acul.
- Nu încercați niciodată să repuneți capacul interior al acului după ce l-ați îndepărtat, deoarece ați putea fi rănit cu acul.
Întreținerea stiloului
- Nu încercați să reparați sau să dezasamblați stiloul.
- Țineți stiloul departe de praf, murdărie și orice tip de lichid.
- Curățați stiloul cu o cârpă umezită cu un detergent ușor.
- Nu încercați să-l spălați, să-l înmuiați în lichid sau să-l ungeți - acest lucru poate deteriora stiloul.
Informații importante
- Nu împărțiți stiloul sau acele cu nimeni altcineva.
- Nu lăsați stiloul la îndemâna altora, în special a copiilor
Verificați fluxul cu un stilou nou
Verificați debitul înainte de o injecție cu un stilou nou. Dacă ați folosit deja stiloul, mergeți direct la pasul „Selecția dozei” H. Rotiți selectorul de doză până când simbolul de control al debitului se aliniază cu indicatorul.
Țineți stiloul cu acul îndreptat în sus. Bateți ușor cartușul de câteva ori cu degetul, astfel încât bulele de aer să se adune pe partea superioară a cartușului. Țineți acul îndreptat în sus și apăsați butonul de injecție până când indicatorul se aliniază. 0 mg.
O picătură de liraglutidă ar trebui să iasă din vârful acului. Dacă nu ies picături, repetați pașii de la E la G de până la patru ori. Dacă totuși nu apare nicio picătură de liraglutidă, schimbați acul și repetați pașii de la E la G Încă o dată . Dacă nu există încă picături de liraglutidă, nu utilizați stiloul injector (pen). Acest lucru indică faptul că stiloul este defect și trebuie utilizat unul nou. Dacă stiloul a lovit o suprafață dură sau dacă bănuiți că este defect, introduceți întotdeauna un nou ac de unică folosință și verificați debitul înainte de a vă face injecția.
Selectarea dozei
Verificați întotdeauna dacă indicatorul se aliniază cu 0 mg.
Rotiți selectorul de doză până când doza necesară se aliniază cu indicatorul (0,6 mg, 1,2 mg sau 1,8 mg).
Dacă ați selectat din greșeală o doză incorectă, pur și simplu corectați-o rotind selectorul de doză înainte sau înapoi până când indicatorul se aliniază cu doza corectă.
Aveți grijă să nu apăsați butonul de injecție în timp ce rotiți selectorul de doză înapoi, deoarece acest lucru poate provoca o scurgere de liraglutidă.
Dacă selectorul de doză se blochează înainte ca doza necesară să se alinieze cu markerul, nu mai există suficient liraglutidă în cartuș pentru o doză completă. În acest caz, puteți:
Împărțiți doza în două injecții: Rotiți selectorul de doză înainte sau înapoi până când indicatorul se aliniază cu 0,6 mg sau 1,2 mg. Injectați doza. Apoi, pregătiți un stilou nou pentru injecție și injectați numărul rămas de mg pentru a finaliza doza.
Puteți împărți doza între stiloul dvs. actual și stiloul nou stilou numai dacă este instruit de profesionistul dvs. din domeniul sănătății. Folosiți un calculator pentru a planifica dozele. Dacă împărțiți greșit dozele, puteți injecta prea mult sau prea puțin liraglutidă.
Injectați doza completă cu un stilou nou: Dacă selectorul de doză se blochează înainte ca indicatorul să se alinieze cu 0,6 mg, pregătiți un stilou nou și injectați doza completă cu stiloul nou.
Nu încercați să selectați alte doze decât 0,6 mg, 1,2 mg sau 1,8 mg. Numerele de pe afișaj trebuie să se alinieze exact cu indicatorul pentru a se asigura că doza corectă este livrată. Când rotiți selectorul de doză, veți auzi „clicuri”. Nu utilizați aceste clicuri ca indicatori pentru a selecta cantitatea de liraglutidă Nu utilizați cântarul de pe cartuș pentru a măsura cantitatea de liraglutidă de injectat, deoarece nu este suficient de precisă.
Injectați doza
Introduceți acul în piele folosind tehnica de injectare prezentată de medicul sau asistenta medicală. Apoi urmați instrucțiunile de mai jos:
Apăsați butonul de injecție până când indicatorul se aliniază cu 0 mg. Aveți grijă să nu atingeți afișajul cu celelalte degete și să nu împingeți selectorul de doză în lateral la injectare, ceea ce ar putea bloca injecția. Țineți apăsat butonul de injecție și lăsați acul sub piele timp de cel puțin 6 secunde. Acest lucru vă va asigura că doza completă este administrată.
Scoateți acul din piele, apoi puteți vedea o picătură de liraglutidă la vârful acului. Acest fenomen este normal și nu afectează doza tocmai administrată.
Introduceți vârful acului în capacul exterior al acului fără a atinge acul sau capacul în sine.
Când acul este acoperit, împingeți cu grijă capacul exterior până la capăt și deșurubați acul. Aruncați acul cu atenție și puneți capacul înapoi pe stilou.
Când stiloul este gol, aruncați-l cu atenție fără ca acul să fie introdus. Aruncați stiloul și acul conform reglementărilor locale.
- Scoateți întotdeauna acul după fiecare injecție și păstrați stiloul injector fără acul atașat.
- Acest lucru reduce riscul de contaminare, infecții, scurgeri de liraglutidă, ace înfundate și doze inexacte.
- Oricine are grijă de pacient trebuie să fie foarte atent atunci când manipulează ace utilizate pentru a preveni infecția încrucișată și rănile cu ac.
Supradozaj Ce trebuie făcut dacă ați luat prea mult Victoza
Dacă utilizați mai mult Victoza decât ar trebui
Dacă utilizați mai mult Victoza decât trebuie, spuneți imediat medicului dumneavoastră, deoarece este posibil să aveți nevoie de tratament medical. Este posibil să aveți greață, vărsături sau diaree.
Dacă uitați să utilizați Victoza
Dacă uitați o doză, luați Victoza imediat ce vă amintiți.
Cu toate acestea, dacă au trecut mai mult de 12 ore de când ar fi trebuit să utilizați Victoza, săriți doza uitată și luați următoarea ca de obicei a doua zi.
Nu utilizați o doză dublă sau creșteți doza în ziua următoare pentru a compensa doza anterioară uitată.
Dacă încetați să luați Victoza
Nu încetați să luați Victoza fără să discutați cu medicul dumneavoastră. Dacă întrerupeți tratamentul, nivelul zahărului din sânge poate crește.
Dacă aveți orice întrebări suplimentare cu privire la acest medicament, adresați-vă medicului dumneavoastră, farmacistului sau asistentei medicale.
Efecte secundare Care sunt efectele secundare ale Victoza
Ca toate medicamentele, acest medicament poate provoca reacții adverse, deși nu apar la toate persoanele.
Efecte secundare grave
Frecvente: afectează până la 1 din 10 persoane
- Hipoglicemie (glicemie scăzută). Semnele de avertizare ale scăderii zahărului din sânge pot apărea brusc și pot include: transpirație rece, piele palidă rece, cefalee, bătăi rapide ale inimii, senzație de rău (greață), senzație de foame, modificări ale vederii, somnolență, senzație de slăbiciune, nervozitate, anxietate , confuzie, dificultăți de concentrare, tremur. Medicul dumneavoastră vă va spune cum să tratați glicemia scăzută și ce să faceți dacă observați aceste semne de avertizare. Iată ce se poate întâmpla dacă luați o sulfoniluree sau insulină bazală. Înainte de a începe să utilizați Victoza, medicul dumneavoastră poate reduce doza acestor medicamente.
Rare: afectează până la 1 din 1000 de persoane
- O formă severă de reacție alergică (reacție anafilactică) cu simptome suplimentare, cum ar fi probleme de respirație, umflarea gâtului și a feței, bătăi rapide ale inimii etc. Dacă apar aceste simptome, trebuie să solicitați imediat asistență medicală și să vă anunțați medicul cât mai curând posibil.
- Obstructie intestinala. O formă severă de constipație cu simptome suplimentare, cum ar fi dureri de stomac, balonare, vărsături etc.
Foarte rare: afectează până la 1 din 10.000 de persoane
- Cazuri de inflamație a pancreasului (pancreatită). Pancreatita poate fi o afecțiune gravă, care poate pune viața în pericol. Dacă observați oricare dintre următoarele reacții adverse grave, opriți Victoza și contactați-vă imediat medicul: Durerea severă și persistentă la nivelul abdomenului (regiunea stomacului) care vă poate ajunge în spate, precum și greața și vărsăturile, pot fi un semn de inflamație. a pancreasului (pancreatită).
Alte efecte secundare
Foarte frecvente: afectează mai mult de 1 din 10 persoane
- Greață (senzație de rău). În general dispare în timp.
- Diaree. În general dispare în timp.
uzual
- A repetat.
Când începeți tratamentul cu Victoza, este posibil să aveți pierderi / deshidratare de lichide în unele cazuri, cum ar fi vărsături, greață și diaree. Este important să evitați deshidratarea, consumând multe lichide
- Durere de cap
- Dificultăți de digerare
- Inflamația stomacului (gastrită). Semnele includ dureri de stomac, greață și vărsături.
- Boala de reflux gastroesofagian (GORD). Semnele includ arsuri la stomac.
- Durere sau umflături în burtă (abdomen)
- Disconfort abdominal
- Constipație
- Gaz intestinal (flatulență)
- Scăderea apetitului
- Bronşită
- Răceală
- Ameţeală
- Creșterea ritmului cardiac
- Oboseală
- Durere de dinţi
- Reacții la locul injectării (cum ar fi vânătăi, durere, iritații, mâncărime și erupții cutanate).
Mai puțin frecvente: afectează până la 1 din 100 de persoane
- Reacție alergică, cum ar fi mâncărime și urticarie (un tip de erupție pe piele).
- Deshidratare, uneori cu funcție renală scăzută
- Malaise.
Raportarea efectelor secundare
Dacă manifestați orice reacții adverse, vă rugăm să spuneți medicului dumneavoastră, farmacistului sau asistentei medicale, care include și orice reacții adverse nemenționate în acest prospect. De asemenea, puteți raporta reacțiile adverse direct prin intermediul sistemului național de raportare enumerat în Anexa V. vă poate ajuta să furnizați mai multe informații despre siguranța acestui medicament.
Expirare și reținere
Nu lăsați acest medicament la vederea și îndemâna copiilor.
Nu utilizați acest medicament după data de expirare înscrisă pe eticheta stiloului și pe cutie după „EXP”. Data de expirare se referă la ultima zi a lunii.
Înainte de deschidere:
A se păstra la frigider (2 ° C - 8 ° C). Nu înghețați. A se păstra departe de compartimentul congelatorului.
În timpul utilizării:
Puteți păstra stiloul pentru o lună sub 30 ° C sau în frigider (2 ° C - 8 ° C), departe de compartimentul congelatorului. Nu înghețați.
Când nu utilizați stiloul, păstrați-l cu capacul pentru a proteja produsul de lumină.
Nu utilizați medicamentul dacă soluția nu este clară și incoloră sau aproape incoloră.
Medicamentele nu trebuie aruncate pe calea apei uzate sau a reziduurilor menajere. Întrebați farmacistul cum să eliminați medicamentele neutilizate. Acest lucru va ajuta la protejarea mediului.
Compoziție și formă farmaceutică
Ce conține Victoza
- Ingredientul activ este liraglutida. Un ml de soluție injectabilă conține liraglutidă 6 mg. Un stilou preumplut conține liraglutidă 18 mg.
- Celelalte componente sunt fosfat disodic dihidrat, propilen glicol, fenol, apă pentru preparate injectabile.
Descrierea a ceea ce arată Victoza și conținutul ambalajului
Victoza este furnizat ca o soluție injectabilă limpede, incoloră sau aproape incoloră, într-un stilou injector (pen) preumplut. Fiecare stilou conține 3 ml de soluție, care corespund la 30 de doze de 0,6 mg, 15 doze de 1,2 mg sau 10 doze de 1,8 mg.
Victoza este disponibil în pachete care conțin 1, 2, 3, 5 sau 10 pixuri. Este posibil ca nu toate mărimile de ambalaj să fie comercializate. Ace nu sunt incluse.
Prospect sursă: AIFA (Agenția italiană pentru medicamente). Conținut publicat în ianuarie 2016. Este posibil ca informațiile prezente să nu fie actualizate.
Pentru a avea acces la cea mai actualizată versiune, este recomandabil să accesați site-ul web AIFA (Agenția italiană pentru medicamente). Declinare de responsabilitate și informații utile.
01.0 DENUMIREA PRODUSULUI MEDICAMENTAL
VICTOZA 6 mg / ml soluție pentru injectare în stilou preumplut
02.0 COMPOZIȚIA CALITATIVĂ ȘI CANTITATIVĂ
Un ml de soluție conține 6 mg liraglutidă *. Un stilou injector (pen) preumplut conține liraglutidă 18 mg în 3 ml.
* analogul peptidei-1 (GLP-1) asemănător glucagonului uman produs prin tehnologia ADN-ului recombinant de către Saccharomyces cerevisiae.
Excipienți cu efecte cunoscute:
pentru lista completă a excipienților, vezi secțiunea 6.1.
03.0 FORMA FARMACEUTICĂ
Soluție injectabilă în stilou injector (pen) preumplut (injecție).
Soluție izotonică clară, incoloră; pH = 8,15.
04.0 INFORMAȚII CLINICE
04.1 Indicații terapeutice
Victoza este indicat pentru tratamentul adulților cu diabet zaharat de tip 2 pentru a obține controlul glicemic:
In combinatie cu:
- Metformin sau o sulfoniluree, la pacienții cu control glicemic insuficient, în ciuda dozei maxime tolerate de metformină sau sulfoniluree numai.
In combinatie cu:
- Metformină și o sulfoniluree sau metformină și o tiazolidindionă la pacienții cu control glicemic insuficient, în ciuda terapiei combinate cu două medicamente.
04.2 Doze și mod de administrare
Dozare
Pentru a îmbunătăți tolerabilitatea gastro-intestinală, doza inițială este de 0,6 mg de liraglutidă pe zi. După cel puțin o săptămână, doza trebuie crescută la 1,2 mg. Se așteaptă ca unii pacienți să beneficieze de creșterea dozei de la 1,2 mg la 1,8 mg și, pe baza răspunsului clinic, după cel puțin o săptămână suplimentară, doza poate fi crescută la 1,8 mg pentru a îmbunătăți și mai mult controlul. Nu sunt recomandate doze mai mari de 1,8 mg pe zi.
Victoza poate fi adăugat la metformina existentă sau metformina și terapia cu tiazolidindionă în combinație. Doza de metformină și tiazolidindionă poate fi menținută neschimbată.
Victoza poate fi adăugat la sulfoniluree sau metformină și sulfoniluree existente în terapia combinată. Când se adaugă Victoza la terapia cu sulfoniluree, trebuie luată în considerare o reducere a dozei de sulfoniluree pentru a reduce riscul de hipoglicemie (vezi pct. 4.4).
Nu este necesar să vă auto-monitorizați glicemia pentru a ajusta doza de Victoza.Cu toate acestea, la inițierea tratamentului cu Victoza în asociere cu o sulfoniluree, poate fi necesară auto-monitorizarea glicemiei pentru ajustarea dozei de sulfoniluree.
Populații speciale
Pacienți vârstnici (> 65 de ani): Nu este necesară ajustarea dozei în funcție de vârstă. Experiența terapeutică la pacienții cu vârsta ≥ 75 de ani este limitată (vezi pct. 5.2).
Pacienți cu insuficiență renală: Nu este necesară ajustarea dozei la pacienții cu insuficiență renală ușoară (clearance al creatininei 60-90 ml / min). Există experiență terapeutică foarte limitată la pacienții cu insuficiență renală moderată (clearance-ul creatininei de 30-59 ml / min) și nu există experiență terapeutică la pacienții cu insuficiență renală severă (clearance-ul creatininei mai mic de 30 ml / min). În prezent, Victoza nu poate fi recomandat pentru utilizare la pacienții cu insuficiență renală moderată sau severă, inclusiv la pacienții cu boală renală în stadiu terminal (vezi pct. 5.2).
Pacienți cu insuficiență hepatică: Experiența terapeutică la pacienții cu orice grad de insuficiență hepatică este în prezent prea limitată pentru a se recomanda utilizarea la pacienții cu insuficiență hepatică ușoară, moderată sau severă (vezi pct. 5.2).
Populația pediatrică: siguranța și eficacitatea Victoza nu au fost stabilite la copii și adolescenți cu vârsta sub 18 ani (vezi pct. 5.1). Nu sunt disponibile date.
Mod de administrare
Victoza nu trebuie administrat intravenos sau intramuscular.
Victoza se administrează o dată pe zi, în orice moment, indiferent de mese, și poate fi injectat subcutanat în abdomen, coapsă sau brațul superior. Cu toate acestea, după ce ați ales cea mai convenabilă oră a zilei, este de preferat să injectați Victoza în aceeași oră. Pentru instrucțiuni suplimentare privind administrarea, vezi secțiunea 6.6.
04.3 Contraindicații
Hipersensibilitate la substanța activă sau la oricare dintre excipienții enumerați la pct. 6.1.
04.4 Avertismente speciale și precauții adecvate pentru utilizare
Victoza nu trebuie utilizat la pacienții cu diabet zaharat de tip 1 sau pentru tratamentul cetoacidozei diabetice.
Victoza nu este un substitut pentru insulină.
Adăugarea liraglutidei la pacienții deja tratați cu insulină nu a fost evaluată și, prin urmare, nu este recomandată.
Experiența clinică la pacienții cu insuficiență cardiacă congestivă NYHA clasa I-II (New York Heart Association) este limitată Nu există experiență clinică la pacienții cu insuficiență cardiacă congestivă NYHA clasa III-IV.
Experiența clinică la pacienții cu boală inflamatorie intestinală și gastropareză diabetică este limitată, prin urmare Victoza nu este recomandată la acești pacienți.Utilizarea Victoza este asociată cu reacții adverse gastrointestinale tranzitorii, inclusiv greață, vărsături și diaree.
Pancreatită
Utilizarea analogilor GLP-1 a fost asociată cu riscul de pancreatită. Au fost raportate puține cazuri de pancreatită acută. Pacienții trebuie informați cu privire la simptomul caracteristic al pancreatitei acute: dureri abdominale severe și persistente. Dacă se suspectează pancreatită., Administrare de Victoza și alte medicamente potențial suspecte ar trebui să fie întrerupte.
Patologia tiroidiană
Evenimente adverse tiroidiene, inclusiv creșterea calcitoninei plasmatice, gușei și neoplaziei tiroidiene, au fost raportate în studiile clinice, în special la pacienții cu boală tiroidiană preexistentă (vezi pct. 4.8).
Hipoglicemie
Pacienții tratați cu Victoza în asociere cu o sulfoniluree pot prezenta un risc crescut de hipoglicemie (vezi pct. 4.8). Riscul de hipoglicemie poate fi redus prin scăderea dozei de sulfoniluree.
Deshidratare
La pacienții tratați cu Victoza au fost raportate semne și simptome de deshidratare, inclusiv insuficiență renală și insuficiență renală acută. Pacienții tratați cu Victoza trebuie informați cu privire la riscul potențial de deshidratare din cauza efectelor secundare gastrointestinale și să ia măsuri de precauție pentru a evita epuizarea lichidelor.
04.5 Interacțiuni cu alte medicamente și alte forme de interacțiune
In vitro, liraglutida a prezentat un potențial foarte scăzut de implicare în interacțiunile farmacocinetice cu alte substanțe active legate de citocromul P450 și legarea de proteinele plasmatice.
Întârzierea ușoară a golirii gastrice indusă de liraglutidă poate afecta absorbția medicamentelor orale concomitente. Studiile de interacțiune nu au arătat o întârziere relevantă clinic a absorbției. Puțini pacienți tratați cu liraglutid au raportat cel puțin un episod de diaree severă. Diareea poate afecta absorbția medicamentelor orale concomitente.
Paracetamol
Liraglutida nu a modificat expunerea totală la paracetamol după o singură doză de 1000 mg. Cmaxul paracetamolului a scăzut cu 31%, iar tmaxul mediu a fost întârziat până la 15 min. Nu este necesară ajustarea dozei pentru utilizare. Concomitent cu paracetamol.
Atorvastatină
Liraglutida nu a modificat expunerea totală la atorvastatină într-o măsură relevantă clinic după administrarea unei doze unice de 40 mg de atorvastatină. Prin urmare, nu este necesară ajustarea dozei de atorvastatină atunci când este administrată cu liraglutidă. Cmaxul atorvastatinei este scăzut. a fost întârziată de la 1 oră la 3 ore cu liraglutidă.
Griseofulvin
Liraglutida nu a modificat expunerea totală la griseofulvină după administrarea unei doze unice de 500 mg de griseofulvină. Cmax-ul a crescut cu 37%, în timp ce tmaxul mediu nu s-a modificat. .
Digoxină
Administrarea unei doze unice de 1 mg de digoxină împreună cu liraglutidă a dus la o reducere a ASC a digoxinei cu 16%; C a scăzut cu 31%. Tmaxul mediu al digoxinei a fost întârziat de la 1 oră la 1, 5 ore Pe baza acestor rezultate, nu s-a ajustat doza de digoxină este necesară.
Lisinopril
Administrarea unei doze unice de 20 mg lisinopril împreună cu liraglutidă a dus la o reducere a ASC a lisinoprilului cu 15%; C a scăzut cu 27%. este necesară.
Contraceptive orale
Liraglutida a redus Cmax de etinilestradiol și levonorgestrel cu 12% și, respectiv, 13%, după administrarea unei doze unice de contraceptiv oral. Tmax a fost întârziată cu 1,5 ore cu liraglutidă pentru ambii compuși. Nu s-au observat efecte relevante clinic asupra expunerii generale la etinilestradiol sau levonorgestrel. Prin urmare, nu se așteaptă ca efectul contraceptiv să fie modificat atunci când este administrat concomitent cu liraglutidă.
Warfarina și alți derivați cumarinici
Nu au fost efectuate studii de interacțiune. Nu poate fi exclusă o interacțiune relevantă din punct de vedere clinic cu substanțe active cu solubilitate redusă sau cu indice terapeutic restrâns, cum ar fi warfarina. Se recomandă monitorizarea mai frecventă a INR la inițierea terapiei cu liraglutidă la pacienții tratați cu warfarină sau alți derivați de cumarină (raport normalizat internațional) .
Insulină
Nu s-a observat nicio interacțiune farmacocinetică sau farmacodinamică între liraglutidă și insulină detemir (Levemir) când s-a administrat o doză unică de 0,5 U / kg de insulină detemir și 1,8 mg liraglutidă la starea de echilibru la pacienții cu diabet zaharat de tip 2.
04.6 Sarcina și alăptarea
Sarcina
Nu există date adecvate privind utilizarea Victoza la femeile gravide. Studiile la animale au arătat toxicitate asupra funcției de reproducere (vezi pct. 5.3). Riscul potențial pentru om este necunoscut.
Victoza nu trebuie utilizat în timpul sarcinii; în schimb, se recomandă utilizarea insulinei Dacă pacientul dorește să rămână gravidă sau rămâne gravidă, tratamentul cu Victoza trebuie oprit.
Timp de hrănire
Nu se știe dacă liraglutida este excretată în laptele uman. Studiile la animale au arătat că transferul liraglutidei și al metaboliților cu relație structurală similară în lapte este scăzut. Studiile non-clinice au arătat o reducere legată de tratament a creșterii neonatale la șobolanii care alăptează (vezi pct. 5.3). Deoarece nu există experiență, Victoza nu trebuie utilizat în timpul alăptării.
Fertilitate
Cu excepția unei ușoare scăderi a numărului de gravuri, studiile pe animale nu au indicat efecte adverse directe asupra fertilității.
04.7 Efecte asupra capacității de a conduce vehicule și de a folosi utilaje
Victoza nu are nicio influență sau are o influență neglijabilă asupra capacității de a conduce vehicule și de a folosi utilaje. Pacienții trebuie sfătuiți să ia măsurile de precauție necesare pentru a evita hipoglicemia în timp ce conduc vehicule sau folosesc utilaje, în special atunci când Victoza este utilizat în asociere cu o sulfoniluree.
04.8 Efecte nedorite
Rezumatul profilului de siguranță
În cinci studii clinice pe scară largă, pe termen lung, peste 2.500 de pacienți au fost tratați cu Victoza singur sau în combinație cu metformină, o sulfoniluree (cu sau fără metformină) sau metformină plus rosiglitazonă.
Cele mai frecvent raportate reacții adverse în timpul studiilor clinice legate de tulburări gastro-intestinale: greață și diaree au fost foarte frecvente, în timp ce vărsăturile, constipația, durerea abdominală și dispepsia erau frecvente. La inițierea terapiei cu Victoza, aceste reacții adverse gastrointestinale pot apărea mai frecvent și, în general, pot dispărea în câteva zile sau săptămâni de tratament continuu. Cefaleea și nazofaringita au fost, de asemenea, frecvente. În plus, hipoglicemia a fost frecventă și foarte frecventă când Victoza a fost utilizat în asociere cu o sulfoniluree. Hipoglicemia severă a fost observată în principal în asociere cu o sulfoniluree.
Lista tabelată a reacțiilor adverse
Tabelul 1 prezintă reacțiile adverse identificate în studiile combinate de fază III cu Victoza. Tabelul prezintă reacțiile adverse care au apărut cu o frecvență> 5% dacă frecvența a fost mai mare la pacienții tratați cu Victoza decât la cei tratați cu compusul comparativ. Tabelul raportează, de asemenea, reacții adverse cu o frecvență ≥2% dacă frecvența a fost> de 2 ori frecvența pentru subiecții tratați cu compusul de comparare. Frecvențele sunt definite ca: foarte frecvente (≥1 / 10); frecvente (≥1 / 100,
Tabelul 1 Reacții adverse identificate în studii controlate pe termen lung de fază III și rapoarte spontane
* Nu este în conformitate cu criteriile menționate mai sus, dar este considerat în continuare o reacție adversă așteptată.
# A se vedea secțiunea 4.4 (Atenționări și precauții speciale pentru utilizare)
Descrierea reacțiilor adverse selectate
Într-un studiu clinic cu monoterapie cu Victoza, ratele de hipoglicemie raportate cu Victoza au fost mai mici decât cele raportate la pacienții tratați cu substanța activă de comparare (glimepiridă). Cele mai frecvent raportate evenimente adverse au fost gastro-intestinale și infecții și infestări.
Hipoglicemie
Majoritatea episoadelor hipoglicemice confirmate în studiile clinice au avut o gravitate ușoară. Nu au fost observate episoade de hipoglicemie severă în studiul cu monoterapie Victoza. Hipoglicemia severă poate să apară mai puțin frecvent și a fost observată în principal cu Victoza în asociere cu sulfoniluree (0,02 evenimente / subiect an). .
Reacții adverse gastrointestinale
Cu Victoza în asociere cu metformină, 20,7% dintre pacienți au raportat cel puțin un episod de greață și 12,6% au raportat cel puțin un episod de diaree. Cu Victoza în asociere cu o sulfoniluree, 9,1% dintre pacienți au raportat cel puțin un episod de greață și 7,9% au raportat cel puțin un episod de diaree. Majoritatea episoadelor au avut o gravitate ușoară până la moderată și au apărut într-o manieră dependentă de doză. Odată cu continuarea terapiei, frecvența și severitatea au scăzut la majoritatea pacienților care au prezentat inițial greață.
Pacienții cu vârsta> 70 de ani pot prezenta mai multe efecte gastro-intestinale atunci când sunt tratați cu liraglutidă.
Pacienții cu insuficiență renală ușoară (clearance-ul creatininei 60-90 ml / min) pot prezenta efecte gastro-intestinale în timpul tratamentului cu liraglutidă.
Retragerea din studiu
În studiile controlate pe termen lung (26 săptămâni sau mai mult), incidența retragerilor din studiu din cauza reacțiilor adverse a fost de 7,8% pentru pacienții tratați cu Victoza și de 3,4% pentru pacienții tratați cu compusul. Pacienții tratați cu Victoza au fost greață (2,8% dintre pacienți) și vărsături (1,5%).
Imunogenitate
În conformitate cu potențialele proprietăți imunogene ale medicamentelor care conțin proteine sau peptide, pacienții pot dezvolta anticorpi împotriva liraglutidei după tratamentul cu Victoza. În medie, 8,6% dintre pacienți au dezvoltat anticorpi. Formarea anticorpilor nu a fost asociată cu o reducere a eficacității Victoza.
Puține cazuri (0,05%) de angioedem au fost raportate în timpul tuturor studiilor clinice pe termen lung cu Victoza.
Reacții la locul injectării
În studiile controlate pe termen lung (26 săptămâni sau mai mult), au fost raportate reacții la locul injectării la aproximativ 2% dintre subiecții tratați cu Victoza. Aceste reacții au fost în general ușoare.
Pancreatită
Au fost raportate puține cazuri (inclusiv pancreatită după punerea pe piață) în timpul studiilor clinice pe termen lung cu Victoza.
Evenimente tiroidiene
Rata de incidență globală a evenimentelor adverse tiroidiene în toate studiile clinice pe termen mediu și lung este de 33,5, 30,0 și 21,7 evenimente la 1000 subiecți-ani expuși la liraglutidă (totală), placebo și liraglutidă, respectiv. total); Evenimentele 5.4, 2.1 și 1.2, respectiv, sunt evenimente adverse grave ale tiroidei.
La pacienții tratați cu liraglutidă, cele mai frecvente evenimente adverse ale tiroidei au fost malignitatea tiroidiană, creșterea nivelului sanguin de calcitonină și gușă.
Ratele de incidență la 1.000 de ani-subiect expuși au fost de 6,8, 10,9 și 5,4 pentru pacienții tratați cu liraglutidă comparativ cu 6,4, 10,7 și 2,1 pentru pacienții tratați cu placebo și respectiv 2, 4, 6,0 și 1,8 pentru pacienții tratați cu medicamente comparative ( total).
04.9 Supradozaj
Într-un studiu clinic cu Victoza, a fost raportat un singur episod de supradozaj cu o doză subcutanată de 17,4 mg (de 10 ori doza maximă recomandată de întreținere de 1,8 mg) la un pacient cu diabet de tip 2. Efectele supradozajului au inclus greață și vărsături severe, dar nu hipoglicemie. Pacientul și-a revenit fără complicații.
În caz de supradozaj, trebuie inițiat un tratament adecvat de susținere, în funcție de simptomele și semnele clinice ale pacientului.
05.0 PROPRIETĂȚI FARMACOLOGICE
05.1 Proprietăți farmacodinamice
Grupa farmacoterapeutică: medicamente utilizate în diabet, alți agenți hipoglicemianți, cu excepția insulinelor. Codul ATC: A10BX07
Mecanism de acțiune
Liraglutida este un analog GLP-1, cu o secvență omologică de 97% la GLP-1 uman, care se leagă de receptorul GLP-1 și îl activează. Receptorul GLP-1 este ținta GLP-1 nativ, un hormon incretin endogen care potențează secreția de insulină dependentă de glucoză din celulele beta pancreatice. Spre deosebire de GLP-1 nativ, liraglutida are un profil farmacocinetic și farmacodinamic la om adecvat pentru administrare o dată pe zi.După administrarea subcutanată, profilul de acțiune prelungit se bazează pe trei mecanisme: auto-asociere, care induce absorbția lentă; legarea cu albumina și o stabilitate enzimatică mai mare față de enzimele dipeptidil-peptidazei IV (DPP-IV) și endopeptidazei neutre (NEP), rezultând un timp de înjumătățire plasmatică lung.
Acțiunea liraglutidei este mediată de o interacțiune specifică cu receptorii GLP-1, ceea ce duce la o creștere a adenozin monofosfatului ciclic (AMPc) .Liraglutida stimulează secreția de insulină într-o manieră dependentă de glucoză. secreția de glucagon, din nou într-o manieră dependentă de glucoză. Astfel, atunci când glicemia este crescută, secreția de insulină este stimulată în timp ce cea a glucagonului este inhibată. În schimb, în timpul hipoglicemiei, liraglutida reduce secreția de insulină și nu împiedică cea a glucagonului. Mecanismul hipoglicemiant implică, de asemenea, o ușoară întârziere în golirea gastrică. Liraglutida reduce greutatea corporală și masa de grăsime prin mecanisme care implică scăderea apetitului și reducerea aportului de calorii.
Efecte farmacodinamice
Liraglutida are o durată de acțiune de 24 de ore și îmbunătățește controlul glicemic prin reducerea glicemiei postului și postprandial la pacienții cu diabet zaharat de tip 2.
Eficacitate clinică
Au fost efectuate cinci studii clinice randomizate, dublu-orb, controlate pentru a evalua efectele Victoza asupra controlului glicemic. Tratamentul cu Victoza a avut ca rezultat îmbunătățiri semnificative din punct de vedere clinic și statistic ale hemoglobinei glicozilate A1c (HbA1c), a glucozei plasmatice în post și a glicemiei postprandiale în comparație cu placebo.
Aceste studii au inclus 3.978 pacienți expuși cu diabet zaharat de tip 2 (2.501 subiecți tratați cu Victoza), 53,7% bărbați și 46,3% femei; 797 subiecți (508 tratați cu Victoza) aveau vârsta ≥ 65 de ani și 113 subiecți (66 tratați cu Victoza) aveau vârsta ≥75 ani.
De asemenea, a fost efectuat un studiu controlat randomizat, deschis, care a comparat liraglutida cu exenatida.
Într-un studiu clinic de 52 de săptămâni, adăugarea insulinei detemir la Victoza 1,8 mg și metformină la pacienții care nu au atins țintele glicemice numai cu Victoza și metformin au dus la o scădere a HbA1c față de valoarea inițială cu 0,54%. Comparativ cu 0,20% din grupul de control cu 1,8 mg Victoza și metformin. S-a confirmat pierderea în greutate. Sa observat o ușoară creștere a ratei episoadelor hipoglicemice nocturne (0,23 față de 0,03 evenimente per subiect pe an). Adăugarea liraglutidei la pacienții deja tratați cu insulină nu a fost evaluată ( vezi pct. 4.4).
Controlul glicemic
Victoza administrat timp de 26 de săptămâni în asociere cu metformină, glimepiridă sau metformină și rosiglitazonă a condus la reduceri semnificative statistic (p
Tabelul 2 Rezultate din două studii care au durat 26 de săptămâni. Victoza în asociere cu metformină și Victoza în asociere cu glimepiridă.
1 rosiglitazonă 4 mg / zi; 2glimepiridă 4 mg / zi; 3metformin 2000 mg / zi
Tabelul 3 Rezultate din două studii care au durat 26 de săptămâni. Victoza în asociere cu metformin + rosiglitazonă și Victoza în asociere cu glimepirid + metformin.
1 Testul de insulină glargină a fost deschis și a fost aplicat în conformitate cu următorul ghid de titrare. Titrarea dozei de insulină glargină a fost gestionată de pacient în conformitate cu instrucțiunile investigatorului.
Ghid pentru titrarea insulinei glargine
a Pe baza recomandărilor individuale ale anchetatorului la vizita anterioară, cum ar fi dacă subiectul a avut episoade de hipoglicemie.
2 Metformin 2000 mg / zi; 3rosiglitazonă 4 mg de două ori pe zi; 4glimepiridă 4 mg / zi.
Procentul pacienților care au obținut reduceri ale HbA1c
Victoza în asociere cu metformină, glimepiridă sau metformină și rosiglitazonă a atins valori HbA1c de ≤6,5% la 26 săptămâni într-un procent semnificativ statistic (p≤0.0001) mai mare de pacienți decât la pacienții tratați cu medicamente menționate anterior fără Victoza.
Glucoza plasmatică în post
Tratamentul cu Victoza singur sau în asociere cu unul sau două antidiabetice orale a dus la o reducere a glucozei plasmatice la jeun de 13-43,5 mg / dL (0,72-2,42 mmol / L). Această reducere a fost observată în primele două săptămâni de tratament.
Glicemia postprandială
Victoza scade glicemia postprandială cu 31-49 mg / dL (1,68-2,71 mmol / L) după toate cele trei mese zilnice.
Funcționalitatea celulelor beta
Studiile clinice efectuate pe Victoza arată îmbunătățirea funcției celulelor beta, măsurată prin modelul de evaluare a homeostaziei pentru funcția celulei beta (HOMA-B) și prin raportul dintre proinsulină și insulină. La un subgrup de pacienți cu diabet zaharat de tip 2 (N = 29) s-a demonstrat o îmbunătățire în prima și a doua fază a secreției de insulină după 52 de săptămâni de tratament cu Victoza.
Greutate corporala
Victoza în asociere cu metformină, metformină și glimepiridă sau metformină și rosiglitazonă a fost asociată cu pierderea în greutate cuprinsă între 1,0 kg și 2,8 kg, care a fost menținută pe parcursul studiilor.
Au fost observate pierderi mai mari în greutate la pacienții care au avut un indice de masă corporală la momentul inițial (Indicele de masa corporala, IMC) mai mare.
Tensiune arteriala
Victoza, pe întreaga durată a studiilor, a redus tensiunea arterială sistolică cu o medie de 2,3-6,7 mmHg față de valoarea inițială și, comparativ cu comparația activă, reducerea a fost de 1,9-4,5 mmHg.
Populația pediatrică
Agenția Europeană a Medicamentului a amânat obligația de a prezenta rezultatele studiilor cu Victoza într-unul sau mai multe subgrupuri ale populației pediatrice cu diabet zaharat de tip 2 (a se vedea secțiunea 4.2 pentru informații privind utilizarea la copii și adolescenți).
Alte date clinice
Într-un studiu comparativ deschis al eficacității și siguranței Victoza (1,2 mg și 1,8 mg) și sitagliptin (un inhibitor DPP-4, 100 mg) la pacienții care nu au fost controlați în mod adecvat în terapia cu metformin (media HbA1c 8,5%), Victoza în două doze au fost statistic superioare tratamentului cu sitagliptin în reducerea HbA1c după 26 de săptămâni (-1,24%, -1,50% vs -0,90%, pierderea în greutate corporală comparativ cu pacienții tratați cu sitagliptin (-2,9 kg și -3,4 kg vs -1,0 kg ,, p
Într-un studiu deschis comparativ al eficacității și siguranței Victoza 1,8 mg administrat o dată pe zi și exenatidă 10 micrograme administrate de două ori pe zi la pacienții care nu au fost controlați corespunzător pe tratament cu metformină și / sau sulfoniluree (media HbA1c 8,3%), Victoza a fost statistic superior exenatidei tratament în reducerea HbA1c după 26 de săptămâni
(-1,12% față de -0,79%; diferență de tratament estimată: -0,33; IC 95% -0,47 - -0,18).
În mod semnificativ mai mulți pacienți au obținut HbA1c sub 7% cu Victoza decât cu exenatidă (54,2% față de 43,4%, p = 0,0015). Ambele tratamente au dus la o pierdere medie în greutate de aproximativ 3 kg. Trecerea pacienților de la exenatidă la Victoza după 26 de săptămâni de tratament a dus la o „reducere suplimentară și semnificativă statistic a HbA1c (-0,32%, IÎ 95%: -0,41 -
-0.24) în săptămâna 40, dar nu este disponibil un grup de control formal. În cele 26 de săptămâni, au apărut 12 evenimente adverse grave la 235 pacienți (5,1%) tratați cu liraglutidă, în timp ce 6 evenimente adverse grave au apărut la 232 pacienți (2,6%) tratați cu exenatidă. Nu a existat un eșantion consistent de evenimente în ceea ce privește clasa de frecvență.
05.2 "Proprietăți farmacocinetice
Absorbţie
Absorbția liraglutidei după injecția subcutanată este lentă, iar concentrația maximă este atinsă la 8-12 ore după administrare. Concentrația maximă estimată de liraglutidă este de 9,4 nmol / l pentru o singură doză subcutanată de 0,6 mg liraglutidă. La doza de 1,8 mg, concentrația medie a stării de echilibru a liraglutidei (ASCa / 24) a fost de aproximativ 34 nmol / L. Expunerea la liraglutidă a crescut proporțional cu doza.Coeficientul de variație intraindividual pentru ASC la liraglutidă a fost de 11% după administrarea unei doze unice.
Biodisponibilitatea absolută a liraglutidei după administrarea subcutanată este de aproximativ 55%.
Distribuție
Volumul aparent de distribuție după administrarea subcutanată este de 11-17 l. Volumul mediu de distribuție după administrarea intravenoasă de liraglutidă este de 0,07 L / kg. Liraglutida se leagă extensiv de proteinele plasmatice (> 98%).
Biotransformare
În cele 24 de ore după administrarea unei doze unice de liraglutidă radiomarcată [3H] la subiecți sănătoși, componenta principală din plasmă a fost liraglutida intactă. Au fost identificați doi metaboliți plasmatici minori (≤9% și ≤5% din expunerea totală la radioactivitatea plasmatică).
Eliminare
După o doză de liraglutidă [3H], nu a fost detectată liraglutidă intactă în urină sau fecale. Doar o mică parte din radioactivitatea administrată a fost excretată sub formă de metaboliți legați de liraglutidă în urină sau fecale (6%, respectiv 5%). Radioactivitatea a fost excretată în urină și fecale în principal în primele 6-8 zile și a corespuns cu trei metaboliți minori, respectiv.
Clearance-ul mediu după administrarea subcutanată a unei doze unice de liraglutidă este de aproximativ 1,2 l / oră cu un timp de înjumătățire plasmatică prin eliminare de aproximativ 13 ore.
Populații speciale
Persoane în vârstăNu s-a demonstrat că vârsta are efecte relevante din punct de vedere clinic asupra farmacocineticii liraglutidei pe baza rezultatelor unui studiu farmacocinetic la subiecți sănătoși și a analizei datelor farmacocinetice ale populației la pacienții cu vârsta cuprinsă între 18 și 80 de ani.
Sex: Nu s-a demonstrat că sexul are efecte semnificative clinic asupra farmacocineticii liraglutidei pe baza rezultatelor analizei datelor farmacocinetice ale populației la pacienți bărbați și femei și a unui studiu farmacocinetic la subiecți sănătoși.
originea etnică: Etnia nu s-a dovedit a avea efecte relevante clinic asupra farmacocineticii liraglutidei pe baza rezultatelor analizei datelor farmacocinetice ale populației la pacienții care au inclus subiecți caucazieni, negri, asiatici și hispanici.
Obezitatea: Analiza farmacocinetică a populației sugerează că indicele de masă corporală (Indicele de masa corporala, IMC) nu are niciun efect semnificativ asupra farmacocineticii liraglutidei.
Insuficiență hepatică: Farmacocinetica liraglutidei a fost evaluată la subiecți cu grade diferite de insuficiență hepatică într-un studiu cu doză unică. Expunerea la liraglutidă a fost redusă cu 13-23% la subiecții cu insuficiență hepatică ușoară până la moderată comparativ cu subiecții sănătoși.
Expunerea a fost semnificativ mai mică (44%) la subiecții cu insuficiență hepatică severă (scor Child Pugh> 9).
Insuficiență renală: Expunerea la liraglutidă a fost redusă la subiecții cu insuficiență renală comparativ cu cei cu funcție renală normală. / min), moderată (CrCl 30-50 ml / min) și severă (dializă CrCl.
05.3 Date preclinice de siguranță
Datele non-clinice nu au evidențiat niciun risc special pentru om pe baza studiilor convenționale de farmacologie de siguranță, toxicitate după doze repetate, genotoxicitate sau toxicitate asupra funcției de reproducere.
Tumorile benigne ale celulelor C tiroidiene au fost observate în studii de carcinogenitate de 2 ani la șobolani și șoareci. La șobolani, nu a existat nicio doză fără niciun eveniment advers observabil (Niciun nivel de efect advers observat, NOAEL). Aceste tumori nu au fost observate la maimuțele tratate timp de 20 de luni. Aceste descoperiri la rozătoare sunt cauzate de un mecanism non-genotoxic, mediat de receptorul specific GLP-1, la care rozătoarele sunt deosebit de sensibile. Relevanța pentru oameni este probabil să fie scăzută, dar nu poate fi exclusă complet. Nu au fost observate alte tumori legate de tratament.
Studiile la animale nu au indicat efecte dăunătoare directe cu privire la fertilitate, dar s-a observat o creștere mică a morții timpurii a embrionilor la doze mai mari. Administrarea Victoza în timpul perioadei de mijloc a sarcinii a determinat reducerea greutății materne și creșterea fetală cu efecte echivoce la coaste la șobolani și modificări scheletice la iepuri. Creșterea neonatală care a fost redusă la șobolani în timpul expunerii la Victoza a persistat în perioada de după înțărcare în grupul cu doze mari. Nu se știe dacă reducerea creșterii neonatale este cauzată de reducerea consumului de lapte datorită unui efect direct. 1 sau reducerea producției de lapte matern datorită scăderii aportului caloric.
06.0 INFORMAȚII FARMACEUTICE
06.1 Excipienți
Fosfat disodic dihidrat
Propilen glicol
Fenol
Apă pentru preparate injectabile
06.2 Incompatibilitate
Substanțele adăugate la Victoza pot provoca degradarea liraglutidei. În absența studiilor de compatibilitate, acest medicament nu trebuie amestecat cu alte produse.
06.3 Perioada de valabilitate
30 de luni.
După prima utilizare: 1 lună.
06.4 Precauții speciale pentru depozitare
A se păstra la frigider (2 ° C - 8 ° C). Nu înghețați.
A se păstra departe de compartimentul congelatorului.
După prima utilizare: a se păstra la temperaturi sub 30 ° C sau la frigider (2 ° C - 8 ° C). Nu înghețați.
Păstrați capacul stiloului pentru a proteja produsul de lumină.
06.5 Natura ambalajului imediat și conținutul ambalajului
Soluție de 3 ml în cartuș (sticlă tip 1), cu piston (bromobutil) și dop (bromobutil / poliizopren) într-un stilou injector multidoză preumplut de unică folosință din poliolefină și poliacetal.
Fiecare stilou conține 3 ml de soluție, care corespund la 30 de doze de 0,6 mg, 15 doze de 1,2 mg sau 10 doze de 1,8 mg.
Pachete de 1, 2, 3, 5 sau 10 pixuri preumplute.
Este posibil ca nu toate mărimile de ambalaj să fie comercializate.
06.6 Instrucțiuni de utilizare și manipulare
Nu utilizați Victoza dacă produsul nu pare clar și incolor.
Victoza nu trebuie utilizat dacă a fost înghețat.
Victoza poate fi administrat cu ace de până la 8 mm lungime și până la 32G subțiri. Stiloul este conceput pentru a fi utilizat cu ace de unică folosință NovoFine sau NovoTwist.
Ace de injecție nu sunt incluse.
Pacientul trebuie sfătuit să arunce acul după fiecare injecție în conformitate cu reglementările locale și să păstreze stiloul injector Victoza fără acul introdus pentru a evita contaminarea, infecția și scurgerile. Respectarea acestor instrucțiuni asigură, de asemenea, precizia dozei.
07.0 DEȚINĂTORUL AUTORIZAȚIEI DE PUNERE PE PIAȚĂ
Novo Nordisk A / S
Novo Allé
DK-2880 Bagsvaerd
Danemarca
08.0 NUMĂRUL AUTORIZAȚIEI DE PUNERE PE PIAȚĂ
EU / 1/09/529 / 001-005
039365010
039365022
09.0 DATA PRIMEI AUTORIZAȚII SAU REÎNNOIREA AUTORIZAȚIEI
30/06/2009
10.0 DATA REVIZUIRII TEXTULUI
05/2012